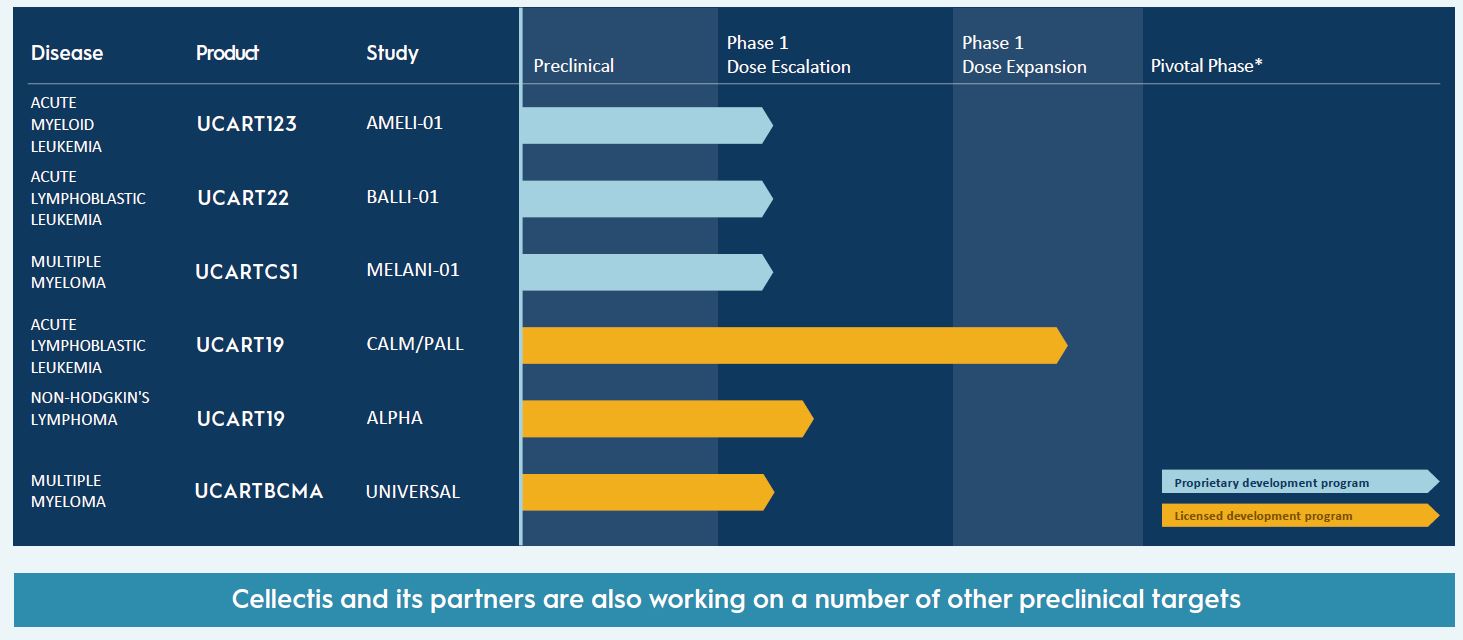
Nicox prêt pour une phase III. La réunion de debriefing de la phase II avec NCX470 dans le glaucome aux Etats-Unis a eu lieu avec la FDA. La société la juge positive, avec la définition du design de l'étude de phase III qui se profile. Les commentaires de l'agence américaine du médicament "ouvrent la voie à l’initiation de la première étude clinique pivotale d’ici la fin du deuxième trimestre 2020", a expliqué le patron de la R&D de Nicox, Tomas Navratil. Les premiers résultats de l'étude baptisée "Mont Blanc" sont attendus au cours du 3e trimestre 2021. L'essai débutera avec deux dosages de NCX 470 0,065% et 0,1%, et se poursuivra avec un seul dosage sélectionné au cours de l’étude grâce un design adaptatif.
Cellectis amende son partenariat avec Servier. Le groupe, qui a aussi publié ses résultats 2019, disposait de 364 M$ de trésorerie à la fin de l'exercice 2019, dont environ 60 M$ pour la filiale Calyxt. Cellectis a les ressources nécessaires jusque "dans l'année 2022" et Calyxt "jusque mi-2021". Les priorités 2020 de Cellectis sont la poursuite du développement d'UCART123, UCART22 et UCARTCS1, la mise en place de capacités de fabrication à Paris et à Raleigh et le renforcement des équipes en fabrication. Pour Calyxt, les priorités vont à l'accroissement des ventes de produits à base de soja à haute teneur en acide oléique, à la poursuite du développement du portefeuille et au renforcement des fonctions support.
Par ailleurs, l'accord entre Servier et Cellectis a été amendé, Servier récupérant une licence exclusive sur tous les produits allogéniques de nouvelle génération ciblant l’antigène CD19 fondés sur des cellules CAR-T allogéniques génétiquement modifiées, y compris les droits pour ALLO-501A. Un paiement initial supplémentaire de 27,6 M$ aura lieu, ainsi que des paiements d'étapes pouvant aller jusqu'à 410 M$ et un taux de redevance sur les ventes nettes relevé du haut de la fourchette à un chiffre au bas de la fourchette à deux chiffres. Cellectis reprend de son côté le contrôle exclusif des cinq cibles CAR-T allogéniques couvertes par l'accord initial, cibles qui n’ont pas été divulguées.
DBV Technologies fait le point. Le groupe disposait de 308,4 M€ de ressources après la levée de fonds menée dernièrement. Le laboratoire, qui espère que Viaskin Peanut, son produit-phare, sera accepté par la FDA cette année, devrait "continuer à constater des pertes à moyen terme", ses ressources actuelles lui permettant de financer son activité jusqu’au cours du premier trimestre 2021, soit un an environ : une phase III et le déploiement d'un réseau de vent coûtent très cher. L'AMM du traitement de l'allergie à l'arachide est donc crucial pour que les investisseurs continuent à accompagner DBV Technologies jusqu'au seuil de rentabilité.
En bref. Pixium Vision active le 1er système Prima implanté chez le 1er patient américain souffrant d'une forme sèche de DMLA de l'étude qui a récemment démarré outre-Atlantique. DMS (diagnostic Medical Systems) émet 3 M€ d'obligations convertibles et touche 0,7 M€ d'une enveloppe dédiée à l'innovation de la Région Occitanie.

 Par
Par 













