Abiomed (Nasdaq: ABMD) annonce que l'Agence américaine des produits alimentaires et médicamenteux (FDA) a accepté et clôturé les rapports d'étude post approbation relatifs aux approbations de pré-mise sur le marché (PMA) pour les pompes cardiaques Impella. La décision de la FDA est une nouvelle affirmation que les pompes cardiaques Impella sont sûres et efficaces pour le choc cardiogénique, l'ICP à haut risque, le choc cardiogénique post cardiotomie, le choc cardiogénique dans le contexte de la myocardite ou de la cardiomyopathie, et l'insuffisance ventriculaire droite.
Ce communiqué de presse contient des éléments multimédias. Voir le communiqué complet ici : https://www.businesswire.com/news/home/20221020005718/fr/
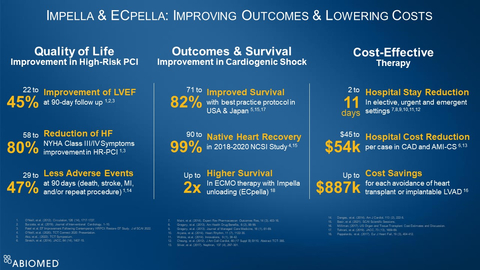
Figure 1
La FDA requiert généralement des études post approbation pour les dispositifs médicaux recevant une PMA, le plus haut niveau d'approbation réglementaire de la FDA. Les études post approbation de la FDA utilisent des données prospectives de haute qualité pour confirmer que les données d'étude clinique soumises à la FDA pour obtenir une PMA s'appliquent à une population de monde réel plus vaste de patients.
Au total, Abiomed a réalisé cinq études post approbation pour Impella durant les sept années depuis l'obtention de sa PMA initiale. Cette vaste expérience multicentrique a été réalisée dans 46 sites et a recruté un total de 1 833 patients.
"Ce jalon réglementaire majeur confirme à nouveau l'innocuité et l'efficacité d'Impella pour une variété d'indications cliniques. Je félicite les médecins-chercheurs qui ont dirigé ces études et remercie les patients qui ont participé", déclare Chuck Simonton, MD, directeur médical d'Abiomed.
La totalité des données Impella collectées aux États-Unis, en Europe et au Japon démontrent qu'Impella améliore les résultats et réduit les coûts (voir figure 1). Ces données incluent:
- Une ICP protégée à assistance Impella améliore la qualité de vie, avec une amélioration entre 22% et 45% de la fraction d'éjection ventriculaire gauche au suivi à 90 jours1, 2, 3, une réduction entre 58% et 80% des symptômes New York Heart Association Class III et IV1, 3 et une réduction entre 29% et 47% des événements indésirables à 90 jours1, 14.
- Impella améliore les résultats pour le choc cardiogénique, avec une survie entre 71% et 82% avec les protocoles de meilleure pratique5, 15, 17, une récupération cardiaque native entre 90% et 99% dans l'étude National Cardiogenic Shock Initiative (NCSI) réalisée de 2018 à 2020 4, 15 et une survie jusqu'à deux fois supérieure pour un traitement ECMO lorsqu'il est combiné à une décharge avec Impella (appelée ECpella)18.
- Impella est une thérapie rentable qui réduit de deux à onze jours la durée des hospitalisations dans des contextes planifiées, urgentes et émergents7, 8, 9, 10, 11, 12, réduit de 45 000 USD à 54 000 USD les coûts hospitaliers par cas pour la coronaropathie et le choc cardiogénique lié à un infarctus aigu du myocarde6, 13 et permet jusqu'à 887 000 USD d'économie pour chaque cas évité de transplantation cardiaque ou de greffe de dispositif d'assistance ventriculaire gauche implantable16.
Impella est la pompe cardiaque la plus étudiée de l'histoire de la FDA, avec des études réalisées depuis 2006 jusqu'à aujourd'hui. Des données de monde réel existent pour près de 200 000 patients Impella (voir figures 2 et 3) et Impella est le sujet de plus de 1 200 publications à comité de lecture. Impella est inclus dans 13 directives de sociétés cliniques.
Les données cliniques et meilleures pratiques apprises durant toutes les études sur Impella réalisées par la FDA, l'Agence japonaise des agents pharmaceutiques et des dispositifs médicaux et en Europe, combinées aux données prospectives et de monde réel, ont étayé la conception des essais contrôlés et randomisés PROTECT IV et RECOVER IV. Ces essais ouverts sont conçus pour atteindre le niveau de confiance nécessaire pour qu'Impella reçoive les recommandations de Classe I pour l'ICP à risque élevé et le choc cardiogénique lié à un infarctus aigu du myocarde.
______________________________
- O’Neill, et al. (2012). Circulation, 126 (14), 1717-1727.
- Burzotta, et al. (2019). Journal of Interventional Cardiology, 1–10.
- Patel et al. EF Improvement Following Contemporary HRPCI: Restore EF Study. J of SCAI 2022.
- O’Neill, et al. (2020). TCT Connect 2020 Presentation.
- Ako, et al. (2022). TCT Symposium.
- Stretch, et al. (2014). JACC, 64 (14), 1407-15.
- Maini, et al. (2014). Expert Rev Pharmacoecon Outcomes Res, 14 (3), 403-16.
- Gregory, et al. (2013). Am Health Drug Benefits, 6 (2), 88-99.
- Gregory, et al. (2013). Journal of Managed Care Medicine, 16 (1), 61-69.
- Aryana, et al. (2014). Heart Rhythm, 11 (7), 1122-30.
- Wohns, et al. (2014). Innovations, 9 (1), 38-42.
- Cheung, et al. (2012). J Am Coll Cardiol, 60 (17 Suppl B) B110. Abstract TCT-385.
- Silver, et al. (2017). Nephron, 137 (4), 297–301.
- Dangas, et al. (2014). Am J Cardiol, 113 (2), 222-8.
- Basir, et al. (2021). SCAI Scientific Sessions.
- Milliman. (2017). US Organ and Tissue Transplant Cost Estimates and Discussion.
- Tehrani, et al. (2019). JACC, 73 (13), 1659-69.
- Pappalardo, et al. (2017). Eur J Heart Fail, 19 (3), 404-412.
À PROPOS DES POMPES CARDIAQUES IMPELLA
Impella CP avec SmartAssist® est approuvé par la FDA américaine pour traiter certains patients atteints d’insuffisance cardiaque avancée subissant des interventions coronariennes percutanées (ICP) électives et urgentes, telles que la pose d’un stent ou l’angioplastie par ballonnet, pour rouvrir les artères coronaires bloquées.
Impella CP avec SmartAssist® et Impella 5.5® avec SmartAssist® sont approuvés par la FDA américaine pour traiter les patients atteints de crise cardiaque ou de cardiomyopathie en état de choc cardiogénique et ont la capacité unique de permettre la récupération cardiaque native, permettant aux patients de rentrer chez eux avec leur propre cœur.
Impella RP® avec SmartAssist est approuvé par la FDA américaine pour traiter l'insuffisance ou la décompensation ventriculaire droite après la greffe d'un dispositif d'assistance ventriculaire gauche, un infarctus du myocarde, une greffe du cœur ou une chirurgie à cœur ouvert.
À PROPOS D’ABIOMED
Basé à Danvers, Massachusetts, États-Unis, Abiomed (Nasdaq: ABMD) est un fournisseur de technologie médicale leader du marché qui fournit des solutions d’assistance circulatoire et d’oxygénation. Nos produits sont conçus pour permettre au cœur de se reposer et guérir en améliorant le flux sanguin et/ou en fournissant une oxygénation suffisante aux personnes souffrant d’insuffisance respiratoire. Pour plus d’informations, rendez-vous sur abiomed.com.
DÉCLARATIONS PROSPECTIVES
Toute déclaration prospective est soumise à des risques et incertitudes tels que ceux décrits dans les rapports périodiques d’Abiomed déposés auprès de la Securities and Exchange Commission. Les résultats réels peuvent différer sensiblement des résultats prévus.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Consultez la version source sur businesswire.com : https://www.businesswire.com/news/home/20221020005718/fr/

